Collegamento esterno: UCLA anestesia
Sodio canali: Malattie
CANALI CALCIO
l
Controllolati dal voltaggio
Ca++ entry canali: Principali
-
Ca++ canali contengono 4 o 5 distinta subunità
-
α-1 subunità
-
Subtypes: Numerosi; differenti tessuto e peptide specificità
-
Localizzazione: Transmembranali
-
Funzioni
-
Sensore voltaico
-
Ca++ selettivo poro: Conductance
-
Struttura: Consiste di 4 interna domini ripetuti (I-IV)
-
Dominio I: responsabile per canale attivazione cinetiche
-
Ogni dominio contiene 6 α-helical transmembranici regioni (S1-S6)
-
S4: Positively carichi; Forma parti della voltaggio sensor
-
2 aggiunta domini fra S5 e S6: Form poro regioni del Canale
-
Verapamile e nifedipine legano
-
Elica 5 e 6 regioni del dominio III
-
Sequenza dopo elica 6 del dominio 4
-
Non N-glicosilate
-
Dimensione: 160-273kD
-
Lambert-Eaton myasthenic sindrome:
IgG lega a domini II e IV di α1A subunità
-
Binding farmaci: Dihydropyridines; Verapamile; Diltiazem
-
Altro subunità: Modulate canale funzioni
-
α2δ (CACNA2D1)

-
Cell locazione: Membrane estendentisi
-
Struttura
-
α2 e δ: Derived dal stessa gene e Collegata by disulfide bridges
-
Glicosilata estensivamente on domini extracellulari
-
Dimensione: 140-170kD
-
Funzione: Regulatory
-
Aumenta ampiezza del Ca++ correnti
-
Binding farmaco: Gabapentin
-
Muscoli scheletrici, Il cuore, Cervello, Ileum
-
Correlati subunità tipi
-
CACNA2D2
 :
Polmone e Testicoli > Cervello, Il cuore, Pancreas
:
Polmone e Testicoli > Cervello, Il cuore, Pancreas
-
CACNA2D3

-
CACNA2D4

-
Associata con coEspressa CACNA1C e CACNB3
-
Espressa ad alto livelli nel cuore e muscoli scheletrici
-
β (CACNB)

-
Localizzazione: Intracellulare; Citoplasmica
-
Dimensione: 52-78kD
-
Subtypes
-
β1 (CACNB1)
 : Muscoli scheletrici, Cervello, Il cuore, Milza
: Muscoli scheletrici, Cervello, Il cuore, Milza
-
β2 (CACNB2)
 : Cervello, Il cuore, Polmone, aorta
: Cervello, Il cuore, Polmone, aorta
-
β3 (CACNB3)
 : Molte tessuti
: Molte tessuti
-
β4 (CACNB4)
 : Cervello, Reni
: Cervello, Reni
-
Subtypes associate con differenti α1 subunità nella membrana
-
β1 associates con α1S
-
β1B associates con α1B e α1E
-
β4 associates con α1A
-
Funzioni: Regulatory
-
Has cAMP-dipendenti proteina chinasi fosforilazione siti
-
Modifies corrente, voltaggio dipendenti e attivazione e inattivazione
-
γ (CACNG)

-
Ca++ canale classes (Controllolati dal voltaggio): Correlati to α-1 subunità
-
Fisiologia del Ca++ canali
-
Basso threshhold: T-tipo
-
Alte threshhold (Attivate a potenziale di membranas nesonor 0 che un riposo): L, N, P-tipo
l
Altro Ca++ canali
l
Ca++ sensors
-
Tipo A: Espressa in fotorecettori cellule; funzione
-
Recoverin

-
Visinin

-
S-modulin

-
Tipo B: Espressa in neuroni
-
VILIP

-
Neuronali calcio sensor-1 (NCS1)
 :
Associata con secretorio granuli
:
Associata con secretorio granuli
l
Ca++ canale malattie
CANALI POTASSIO
l
Principali e Tipi di K+ Canali
-
Structure4
-
K+ canale
-
Interno e Outer membrane faccia
-
Layers di aromatic aminoacidi: Triptofano; Tirosina
-
Form cuff attorno poro
-
Tirare l'apertura dei pori simili springs
-
Filtro di selettività
-
Narrow regioni vicino esterna faccia della membrana
-
Contiene glicina-tirosina-glicina residui
-
Allineati by carbonyl spina dorsale di conservate aminoacidi
-
? Carbonyl oxygens agire come surrogate H2O:
Coordinate 2 dehydrated K+ ioni seduta in line in canale
-
Ions travel attraverso le canale in singolo file
-
controllati dal voltaggio K+ canali (Kv)
-
6 Transmembranali (TM) regioni (S1-S6)
-
4 Subunità surround centrale poro (TM canale): S5 e S6 regioni di ogni subunità
-
Filtro di selettività (P regioni): idrofobo sequenze fra last 2 TM regioni; Contiene Gli-Tir-Gli
-
Voltaggio sensing: multipluna positivaly carichi aminoacidi in 4a TM regioni (S4)
-
Rettificante internamente K+ canali (Kir)
-
2 Transmembranali regioni (M1 e M2): Correspond to last 2 TM regioni (S5 e S6) in Kv canali
-
4 Subunità surround centrale poro (TM canale)
-
P regioni: Separates M1 e M2
-
Non-conduzione una positiva potenziale di membranas
-
K+ canale funzioni: Spesso voltaggio-sensibile
-
Ritardato rectifier K+ canali
-
Ritardato attivazione; Lenta inattivazione
-
Permette efficienti repolarization dopo potenziali di azione
-
Blockers: 4-aminopiridina; Dendrotoxins; Feniciclidina; Phalloidin; 9-aminoacridine;
Margatoxin; Imperator tossine; Charybdotoxin
-
Struttura: Tetramero di α-subunità ± β-subunità
-
Inward rectifier K+ canali (Kir)
-
Proprietà generali
-
K+ canale: Maggiore tendancy to permettono potassio to flow dentro la cellula piuttosto che fuori
-
Voltaggio dependance: Regolati by concentrazione di extracellulare potassio
-
Rettificazione retrograda principalmente dovuta alla blockage di outward corrente by interna magnesio
-
possono essere bloccato by esterna Ba++
-
Localizzazione subcellulare: Integral proteine di membrana
-
Attività di Kir canali è dipendenti on interazioni con fosfatidilinositolo 4,5-bisfosfato (PIP2)
-
Funzioni
-
Mantenere a potenziale di riposo di membrana vicino equilibrio potenziale per K+ ioni
-
Contribute to cellule eccitabilità
-
Tissues: Excitable; Il cuore, Cervello, Muscoli scheletrici
-
Non-conduzione una positiva potenziale di membranas
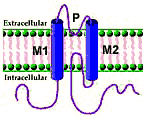
-
Tipica Kir: grossi Famiglia
-
Ruoli in eccitabilità ed una riposo conduttanza dei cellule muscolari e neuroni
-
Alcune ATP-sensibile o GTP-attivata
-
Struttura
-
2 membrano-tensive domini in ogni subunità (M1 e M2)
-
Correspond to last 2 TM regioni (S5 e S6) in Kv canali
-
Terminale N dominio: Intracellulare
-
Terminale C dominio: Intracellulare
-
No voltaggio sensor in voltaggio-controllati canali
-
omologhe to regioni in voltaggio-controllati K+ canale
-
Transmembranali regioni 5 (M1) e 6 (M2)
-
P regioni
-
Separates M1 e M2
-
Poro elica
-
Loop regioni: Maggiore ioni selettività filter; Amino acido TVGYG core
-
La subunità clustering
-
omotetrameri o Heterotetrameri
-
4 Subunità surround centrale poro (TM canale)
-
Currents
-
grossi inward a potenziali negative to K+ equilibrio potenziale
-
Sottili outward correnti a più positive potenziali
-
Blockers: LY97241; Gaboon viper venom; Sr++;
Ba++; Cs+
-
Regolazione: esterne K+; Internal Mg++;
Intracellulare polyamines, ATP o proteine G
-
Esseri umani ether-a-go-go (HERG; KCNH)

 :
Atipica con 6 dominio transmembranico
:
Atipica con 6 dominio transmembranico
-
Vedi: specifico canale tipi; Malattie
-
Ca++ sensibile K+ canali: Generate potenziale di membrana oscillations; Afterhyperpolarization
-
ATP-sensibile K+ canali
-
Regolazione: ATP-inibita; Nucleoside difosfato-facilitated
-
Proprietà
-
Rettificante internamente; pH sensibile
-
Non voltaggio-dipendenti
-
Openers: Levcromakalim; Diazossido; Aprikalim; Pinacilil
-
Blockers: Glibenclamide; Tolbutamide; Phentolamine: Ciclazindol; Lidocaine
-
Struttura: Tetramero di 2-transmembranici subunità
-
Funzione: Glucosio sensor in β-cellule
-
Na+ attivata K+ canali
-
Voltaggio-insensitive
-
Blockers: Mg++; Ba++
-
Cell volume sensibile K+ canali
-
Attivate by aumentato cellule volume
-
Blockers: Quinidine; Lidocaine; Cetiedil
-
Tipo A K+ canali: Rapido attivazione e inattivazione
-
Blockers: 4-aminopiridina; Quinidine; Mast cellule degranulating peptide; Feniciclidina; Dendrotoxins
-
? Regolazione di fast repolarizing fase dei potenziali di azione: ritardo spiking
-
Struttura: Tetramero di α-subunità + Intracellulare β-subunità
-
β-subunità Può confer rapida inattivazione
-
Recettore-accoppiate K+ canali
-
Muscarinic-inattivarono
-
Lenta attivazione; Non-inattivante; Non-rectifying
-
Openers: Somatostatin; β-adrenoceptor agomisti
-
Blockers: Ba++; Bradykinin
-
Atrial muscarinic-attivata
-
Inward rectifying
-
Blockers: Ba++; Cs+; 4-aminopiridina; TEA; Chinina
-
Struttura: Tetramero di KCNJ3 e KCNJ5
-
Subunità: molecolare famiglie
-
Controllolati dal voltaggio K+ canali (Kv)
-
6 dominio transmembranico
-
Attivate by depolarizzazione
-
Presente nei entrambi eccitabili e nonexcitable cellule
-
Funzioni
-
Regola a potenziale di riposo di membrana
-
Controllo della sagoma e frequenza dei potenziali di azione
-
α subunità: 2 tipi
-
Funzionale by stessi
-
Elettricamente silenti: Modulate attività di funzionale α subunità
-
Tipi
-
Collegamento esterno: UCLA anestesia
-
Canali potassio: Rettificante internamente (Kir)
-
Proprietà generali
-
Generale famiglie
-
Kir2.0
-
In azione: Forte rectification
-
Funzione: Manutenzione e controllo delle cellule eccitabilità
-
Interazione cons: Fra i tutti Kir2 canali; SAP97

-
Kir3.0 (GIRK)
-
KCNJ sottotipi: 3, 5, 6, 9
-
G-proteina controllati
-
tetrameri forma KG canali
-
Espressa attraverso CNS
-
Acetilcolina-rispondente inward rectifier composto di Kir3.1 e Kir3.4
-
Kir1.0/4.0: K+ trasportatori
-
Kir5.1
-
Homomeric assemblaggio con PSD-95
-
Correlati to PKA-mediata signalling
-
Kir6.0
-
ATP sensibile
-
Associata con sulfonylurea recettori
-
Kir7
-
Molto basso singolo canale conduttanza
-
Basso sensibilità to blocco by esterna Ba++ e Cs+
-
No dipendenti di inward rectification proprietà on interna bloccanti Mg++
-
Helps to set potenziale di membrana
-
Kir Tipi: grossi Famiglia

-
Esseri umani ether-a-go-go (HERG; KCNH)
 :
Correlati to ciclico nucleotide-controllati catione canali
:
Correlati to ciclico nucleotide-controllati catione canali
-
KCNK Famiglia: 4 dominio transmembranico; 2 poro (P) (tandem poro) domini
-
KCNK1 (TWIK)
 :
:
-
Weakly inward-rectifying corrente
-
Controllo di retroterra K+ membrane conductances
-
Espressa nel CNS
-
KCNK2 (TREK)
 :
:
-
Outward rectifying
-
sensibili to extracellulare K+ e Na+
-
Espressa nel CNS
-
KCNK3 (TASK)
 :
? ruolo in cellule risposta to extracellulare pH
:
? ruolo in cellule risposta to extracellulare pH
-
KCNK4 (TRAAK)

-
Espressa in nervose tessuti
-
Currents: K+ selettivo, instantaneous, noninactivating, e outwardly rectifying
-
Potentiated by polyunsaturated acidi grassi, per es. arachidonic acido
-
KCNK5 (TASK2)
 : Renale
: Renale
-
KCNK6 (TWIK2; TOSS)
 :
Molte tessuti; Occhi cellule gangliali e interna nucleare piani
:
Molte tessuti; Occhi cellule gangliali e interna nucleare piani
-
KCNK7
 (TWIK-1-simili)
(TWIK-1-simili)
-
Espressa nel CNS
-
No canale attività quando espresso da sola
-
KCNK8
-
Espressa in occhio, polmone, e stomaco
-
No canale attività quando espresso da sola
-
KCNK9
 (TASK3 proteina)
(TASK3 proteina)
-
Espressione: ? selettivamente in cervelletto o Espressione selvatica
-
Oncogenic: Over-espresso in umano carcinomas
-
Tempo-indipendente, noninactivating K+-selettivo corrente
-
Current altamente sensibile to alterazioni in extracellulare pH
-
Blocked by barium, quinidine, e lidocaina
-
KCNK10
 (TREK2)
(TREK2)
-
Rapidamente attivante e noninactivating outward rectifier K+ canale correnti
-
stimolazione
-
Fortemente by polyunsaturated acidi grassi: Arachidonic acidi
-
Cell membrane stiramento
-
Intracellulare acidification
-
Inhalational generale anestetici
-
Transientemente attivata by riluzole
-
KCNK12
(THIK-2; Tandem poro dominio Alotano Inhibited K+ canale)


-
Espressa in encefalo e reni
-
No funzionale corrente scoperta
-
KCNK13 (THIK-1)

-
Ubiquitous espressione: Alte in olfattivi, septal, ipotalamico e talamico nuclei di encefalo
-
Weak inward rectification
-
Current aumentano by arachidonic acido
-
Current inibita by alotano
-
KCNK14
-
KCNK15

-
Espressione nel cuore, muscoli scheletrici, testicoli, tiroide gland, adrenale gland, salivary gland, pancreas
-
KCNK16

-
Proprietà del canale
-
K+ correnti: Outward rectifying; Lost by innalzamento di extracellulare K+
-
Attivate a alcalino pH
-
Current sensibile to barium, quinine e anestetici volatili
-
Distribuzione: Pancreas
-
KCNK17

-
Proprietà del canale
-
K+ correnti: Outward rectifying; Lost by innalzamento di extracellulare K+
-
Attivate a alcalino pH
-
Current sensibile to barium ± quinine e anestetici volatili
-
Distribuzione: fegato, polmone, placenta, pancreas, sottili intestine, aorta
-
KCNM: Ca++ sensibile; grossi conduttanza canali (MaxiK)
-
Generale
-
Respond to aumentato Intracellulare Ca++ ioni concentrazioni
-
subunità α: Poro formando
-
β-subunità: Modulatory
-
sensibili to peptide tossine: Charybdotoxin, Iberiotoxin; Bind to
β-subunità
-
Funzioni
-
Play un ruolo in leucociti-indotte microbial morte
-
Translate Ca++ segnali to vasoregulation
-
KCNMA1
 :
Ca++ attivata; grossi conduttanza
:
Ca++ attivata; grossi conduttanza
-
Media fast, Ca++-attivata K+ corrente
-
17-β-estradiol lega a β subunità
-
Maggio giocano ruolo in cochlOrecchie frequenza selettività
-
Fetal muscoli scheletrici
-
KCNMB1

-
Muscolatura liscia, Muscoli scheletrici (Fetal), Cervello (Hippocampus, Corpus calosum)
-
KCNMB2
 :
Ca++ attivata; grossi conduttanza
:
Ca++ attivata; grossi conduttanza
-
La subunità induces fast inattivante correnti che possono essere aumentato by voltaggio e Intracellulare Ca++
-
KCNMB3

-
KCNMB4

-
KCNN: Calcio-attivata, Sottili/Intermediate conduttanza
-
KCNN1
 (SK1)
(SK1)
-
Cervello, Il cuore
-
Sottili conduttanza, Ca++ attivata
-
Apamin sensibile
-
KCNN2
 (SK2)
(SK2)
-
Cervello, Ghiandole adrenalei, Retinica cellule gangliali e neuroni
-
Apamin, Scyllatoxin e Tubocurarine sensibile
-
Charybdotoxin insensitive
-
KCNN3
 (SK3)
(SK3)
-
Sottili conduttanza, Ca++ attivata
-
Intermediate apamin sensibilità
-
Contiene 2 CAG ripetute sequenze:
-
Cervello, Il cuore, Muscoli scheletrici (Embryonic), fegato
-
KCNN4
 (SK4)
(SK4)
-
T-linfociti; Colon, Muscolatura liscia, RBCs, Neuroni
-
Intermediate conduttanza
-
Ca++ attivata
-
Blocking agenti: Clotrimazole; Charybdotoxin
-
Maggiore percorso per cellule riduzione via KCl e acqua perdita in sickle cellule malattie
-
KCNT Famiglia
 : Intermediate-conduttanza calcio-attivata
: Intermediate-conduttanza calcio-attivata
-
KCNT1 (Slack)
-
Espressione
-
Moderate to alto in tutti tessuti
-
La più alta nel fegato e encefalo
-
Bassaest nei muscoli scheletrici
-
Interagisce con Slo subunità
-
SUR (Alte-affinità sulfonylurea recettore)
-
SUR1 (ABCC8)
 : Pancreatic islets
: Pancreatic islets
-
SUR2 (ABCC9)
-
2A: Il cuore
-
2B: Cervello, fegato, Scheletro e Muscolatura liscia, Vescica
-
Plasmolipina

-
Cervello (mielina) e Reni
-
Forma K+ specifico, voltaggio-dipendenti canali se aggiunta alla doppia lamina lipidica
l
Malattie di K+ Canali
IPOMAGNESEMIA
-
Clinica
-
Attacchi epilettici
-
Tetania
-
parestesie
-
Debolezza
-
Genetica sindromi
-
Primario ipomagnesemia

l
Claudin 18; Cromosoma 3q; Recessive
-
Ipomagnesemia con secondaria ipocalcemia

l
Cromosoma 9q12-q22.2; Recessive
-
Magnesio e Potassio deplezione (Gitelman sindrome)

l
Na-Cl cotrasportoer
 ;
Cromosoma 16q13; Recessive
;
Cromosoma 16q13; Recessive
-
Ipomagnesemia 2, Renale (HOMG2)

l
Cromosoma 11q23; Recessive
CANALI ANIONICI, SCAMBIATORI e TRASPORTATORI
-
Anion lo scambio proteine:
-
SLC4A1 (AE1)

 : Erythrocyte band 3 proteina
: Erythrocyte band 3 proteina
-
Maggiore integrale glicoproteina in eritrociti membrane
-
Polimorfismi determine Diego sangue gruppo
-
Malattie: Sferocitosi; Ovalocytosis; Acidosi tubulare renale ;
Paralisi periodica ipopotassica
-
Altro
-
SLC4A2
 : Anion scambior; ? Choroid plessi, GI e Altro
: Anion scambior; ? Choroid plessi, GI e Altro
-
SLC4A3
 : Anion scambior; Cardiaco e Cervello
: Anion scambior; Cardiaco e Cervello
-
SLC4A4
 :
Na Bicarbonato cotrasportoer; Renale; Acidosi tubulare renale , glaucoma, cataratta, e band keratopathy
:
Na Bicarbonato cotrasportoer; Renale; Acidosi tubulare renale , glaucoma, cataratta, e band keratopathy
-
SLC4A5
 :
Na Bicarbonato cotrasportoer; Pancreas
:
Na Bicarbonato cotrasportoer; Pancreas
-
SLC4A6
 :
Na Bicarbonato cotrasportoer; Retina
:
Na Bicarbonato cotrasportoer; Retina
-
SLC17A5 (Sialina)
 :
Salla sindrome (Sialic acido accumulo)
:
Salla sindrome (Sialic acido accumulo)
-
SLC26A3: Down-regolata in adenoma (DRA)


-
? solfato trasportatore
-
Congenita chloride diarrea

-
SLC26A4: trasportatore di Cloro e Iodide

-
non sindromica Sordità, congenita (DFNB4)

-
Pendred sindrome

-
Ingranditi vestibular aqueduct sindrome

-
Voltaggio dipendenti anione selettivo canale proteine:
VDAC1
 ;
VDAC2
;
VDAC2

-
Outer membrane mitocondriali ±
membrana plasmatica
-
Canali per sottili idrofilo molecole
-
BCL2 proteine legano to VDAC: Regola mitocondriale
potenziale di membrana e rilascio della citocromo c durante apoptosi
-
VDAC1
-
percorso per movimenti di adenina nucleotidi attraverso le membrana mitocondriale esterna
-
Mitocondriali Legante site per esochinasi e glicerolo chinasi
-
Organic anione trasportatore
(OATP)

-
Na+-indipendente trasporto di organico anions, per es. bile acidi
-
Canalicular multispecifico organico anione trasportatore (cMOAT)

-
Dubin-Johnson Sindrome

-
solfato anione trasportatore

CANALI CATIONICI: CICLICI
CONTROLLATI DAI NUCLEOTIDI
-
CNG canali
-
α1 subunità (CNGA1)

-
Localizzazione: Bastoncelli fotorecettori
-
Integral proteine di membrana
-
Media Visione segnali transduction
-
Cyclic GMP è 2a messenger: Activates catione canale ® Bastoncelli fotorecettori depolarizzazione
-
Polymerizes con CNGB1
-
stimolazione: Darkness opens canali to Na+ e Depolarizes fotorecettori
-
Inibizione: Luce attiva cGMP causante canale chiusura e Hyperpolarizes fotorecettori
-
Malattia: Retinite pigmentosa
-
α2 subunità (CNGA2)
 :
Olfactory
:
Olfactory
-
Attivate by 3 molecole del CaTP
-
Canale ioni: Na+ e Ca++
-
α3 subunità (CNGA3)

-
Localizzazione: Testicoli; Reni; Il cuore; Occhi
-
Malattia: Monocromazia dei bastoncelli (Total color CECITA'; Achromatopsia 2
 )
)
-
β1 subunità (CNGB1)
 :
Retina con CNGA1
:
Retina con CNGA1
-
β3 subunità (CNGB3)
 :
Achromatopsia 3 (Pingelapese CECITA'
:
Achromatopsia 3 (Pingelapese CECITA'
 )
)
-
Cervello CNG 1 e 2: controllati dal voltaggio K+ canali
-
Ca++ transporting ATPasi
-
ATP-controllati Cation Canale (ACC) Famiglia (I recettori P2X)
-
Cu++ transporting ATPasi 7
-
Wilson's
 : β polipeptidiche
: β polipeptidiche

-
Menkes
 : α polipeptidiche
: α polipeptidiche

-
occipitale horn sindrome
 : α polipeptidiche
: α polipeptidiche

-
K+/H+ ATPasi:
B12 carenza
-
Hyperpolarization-attivata ciclico nucleotide-controllati K+ canali (HCN)
CANALI IONICI
CONTROLLATI DAI PROTONI: Nervose
-
Generale
-
Due-transmembranici-dominio proteine
-
Correlati to putative mechanosensory DEG/ENaC canali
-
Gated by riduzione in extracellulare pH
-
La maggior parte sottotipi espresso in DRG: ASIC1b e ASIC3 hanno preferenziale espressione in sensorio ganglia
-
Tipi
-
Dorsal radice acidic sensing canale (DRASIC; ASIC-3)
 :
:
-
Form hetermultimeric canali
-
Localizzazione
-
DRG neuroni: grossi-diametro mechanoreceptors; non mielinizzati sottili-diametro peptidergic nociceptors
-
Sensoria nervo terminali: Meissner corpuscles lanceolate fibre; Rapidamente adattamento basso-soglia mechanoreceptors
-
Free nervo endings: ? Nocicettori
-
Basso pH opens canale to Na+ e Ca++
-
Curent: Biphasic; Rapidamente inattivante e sostenuto componenti
-
Inibitore: Amiloride
-
Funzioni: Correlati to
-
Stimoli: Cutaneous tatto; Acid
-
Ruolo per ASIC3 in tonici inibizione di alto-intensità dolore segnali
-
ASIC3-deficiente topo
-
Ridotta sensibilità di alcune mechanoreceptors to noxious pinch
-
aumentata sensibilità alla luce tatto
-
aumentata comportamentali risposta to alto-intensità nocicettive stimolo
-
Acidic sensing canali ionici
 (ASIC-1)
(ASIC-1)
-
2 varianti
-
alfa (ASIC-α): Espressa largamente in encefalo
-
Beta (ASIC-β): Espressa solo on sensorio neuroni
-
Inibitore: Amiloride
-
Ion permeabilità: Na+ > Ca++ > K+
-
Attivazione: Temporanea (Rapidamente inattivante); Con rapida extracellulare acidification
-
Mammalian degenerin omologo (MDEG-1; ACCN1; BNC1) (ASIC-2)
 : Na+ canale
: Na+ canale
-
Inibitore: Amiloride
-
Excited by: Capelli movimenti; Acid, ASIC2b con ASIC-3
-
fisiologico funzione
-
Ruolo in: meccanicaly stimolato graded potenziale in assonali recettori
-
Nocicezione: Acid-indotte cardiaca dolore
-
Non correlate to rilevazione di noxious meccanica stimolo
-
Localizzazione
-
ASIC-2 deficiente topo
-
Rapidamente adattamento mechanoreceptors: Ridotta sensibilità to capelli movimenti
-
Alcune ridotta sensibilità in risposta di lentamente adattamento mechanoceptors
-
ASIC-4
 (SPASIC)
(SPASIC)
-
Espressa in pituitaria e encefalo
-
Capsaicina recettore (VR1)
TRASPORTATORI Na-K-Cl
CO (Solute portatore Famiglia (SLC) 12)
-
Generale
-
Integral proteine delle membrane
-
Mediate accoppiate trasporto di Na+, K+, e Cl-
attraverso membrana plasmatica
-
KCC Famiglia membri: Potassio-Cloro cotrasportoers
-
Tipi
-
SLC12A1
 : Renale
: Renale
-
Media attiva riassorbimento di NaCl
-
Localizzazione: Spessa ascendente arto della ansa di Henle
-
Site di azione di diuretici: Furosemide; Bumetanide
-
Malattia: Bartter sindrome (Prenatale)

-
SLC12A2

-
Espressa in molte tessuti: Secretorio epitelio
-
Media attiva Cl- secrezione
-
Topo mutazione
-
Sordità; Shaker/waltzer comportamento, indicative di interna-Orecchie difetti
-
Endolymph secrezione: Ridotta
-
SLC12A3
 : Renale
: Renale
-
Distale tubuli convoluti: Principal mediator di Na+ e Cl- in questo segmento
-
Obiettivo di thiazide diuretici
-
Malattia: Bartter sindrome (Gitelman variante)

-
SLC12A4 (KCC1)
 :
Precoce eritroidei maturazione
:
Precoce eritroidei maturazione
-
SLC12A5 (KCC2)


-
Cloro extruder in encefalo
-
Promuove fast hyperpolarizing postsinaptico inibizione
-
SLC12A6 (KCC3)

-
Tissues: Vascolare endoteliali; Cervello; Il cuore; Muscoli scheletrici; Reni
-
Aumentati attività con cellule gonfi
-
Malattia: Andermann sindrome (HMSN e Agenesi di Corpus Callosum)
-
SLC12A7 (KCC4)
 :
:
-
Espresso maggiormente in reni, cuore, polmone, e fegato
-
Knockout topo
-
Funzione: Potassio riciclaggio nella Deiters cellule dopo exit dal cellule cigliari
Stretch-attivata non-selettivo catione canali (SA canali)
-
meccanismi: meccanicaly-controllati canali
-
Localizzazioni
-
Orecchie
-
Fusi muscolari
-
Vascolare cellule endoteliali
-
Neurosensory epitelio
-
Tipi
CANALI IONICI
RECETTORI DI TRANSIENTI DI POTENZIALE (TRP)
Generale caratteristiche
-
Struttura
-
Subunità: Contiene 6 membrane estendentisi domini
-
Similarity
-
controllati dal voltaggio K+ (Kv)
-
Cyclic nucleotide controllati (HCN e CNG)
-
Polycystic reni malattie proteine
-
Form tetrameri
-
Poro lined by dominio transmembranico 5 e 6
-
Localizzazione: Membrana plasmatica
-
Funzioni
-
Non-selettivo catione canale
-
Agisce to deriva potenziale di membrana to 0 mV
-
Depolarizzazione dal a potenziale di riposo di membranas
-
Allow Ca++ influsso in non-eccitabili cellule
-
Alcune sono temperature sensibile
-
Canale apertura: Collegata to attivazione di 2a messenger sistemi
-
Attivazione della fosfolipasi C
-
generazione di Inositol-1,4,5-trifosfato (Ins(1,4,5)P3)
-
Opening di Ins(1,4,5)P3 recettore
-
Response to deplezione di Intracellulare calcio pools (Capacitative calcio entry)
-
Alcune TRP gioca un ruolo in phototransduction
TRP families12
-
TRPC recettori (STrpC)
-
TRPC1

 :
Espressione diffusa; Attivate by diacilglycerol (DAG) e Intracellulare Ca++ deplezione
:
Espressione diffusa; Attivate by diacilglycerol (DAG) e Intracellulare Ca++ deplezione
-
TRPC2
 :
Vomeronasal organo, Testicoli, Il cuore, Cervello, Sperm; ? Pseudogene in esseri umani
:
Vomeronasal organo, Testicoli, Il cuore, Cervello, Sperm; ? Pseudogene in esseri umani
-
TRPC3
 :
Cervello, Placenta, Il cuore, Muscoli; Attivate by DAG e InsP3R; Inward e Outward rectifying
:
Cervello, Placenta, Il cuore, Muscoli; Attivate by DAG e InsP3R; Inward e Outward rectifying
-
TRPC4
 :
Cervello corteccia, Testicoli, Placenta, Adrenale, Endotelio; Recettore operated
:
Cervello corteccia, Testicoli, Placenta, Adrenale, Endotelio; Recettore operated
-
TRPC5
 :
Cervello; Recettore operated
:
Cervello; Recettore operated
-
TRPC6
 :
Polmone, Cervello, Muscoli (Smooth); Attivate by DAG; Inward e Outward rectifying
:
Polmone, Cervello, Muscoli (Smooth); Attivate by DAG; Inward e Outward rectifying
-
TRPC7
 :
Polmone, Cervello, Muscoli (Smooth), Il cuore, Occhi; Attivate by DAG; Inward e Outward rectifying
:
Polmone, Cervello, Muscoli (Smooth), Il cuore, Occhi; Attivate by DAG; Inward e Outward rectifying
-
TRPV recettori
-
Generale: TRPV Famiglia contiene molte calore-sensibile canali
-
TRPV1: Vanilloid recettore (VR1); Capsaicina recettore

-
Localizzazione
-
Cervello
-
Midollo spinale: Laminae II e III di dorsale horn
-
Periferici sensorio neuroni
-
Localizzazione: DRG; Trigemino; Nodose
-
Dimensione: Sottili to medium diametro
-
Peptide e Non-peptide releasing
-
Altro: Urinario vescica epitelium, Muscolatura liscia, Epidermal keratinocytes
-
Localizzazione subcellulare: Membrana plasmatica
-
Fisiologia
-
Outwardly rectifying
-
Canali dei cationi: Relatively selettivo per Ca++
-
Attivate by
-
Capsaicina: Sensoria cellule gangliali e assoni
-
Resiniferatoxin (RTX): altamente potente analog
-
Anandamide: Cannabinoid recettore ligando; Sensitized to anandamide by proteina chinasi C
-
Temperatura
-
Calore to noxious Gamma: 45 °C (Inferiori dopo sensitization
-
Steep temperature dependance
-
Basso pH (Acid)
-
2 effetti di protoni
-
Attivazione di VR1 a room temperature: Con extracellulare pH < 6
-
Currents assomigliavano sostenuta componente di protoni-evocata risposta in sensorio neuroni
-
Potentiate risposta di VR1 a capsaicin o calore
-
Concentration Gamma (pH 6–8) matches locale acidosi Associata con
tessuto lesione
-
Più mediation di sostenuta che transitoria risposta
-
Inibitori
-
Capsazepine
-
Ruthenium rosso
-
Phosphatidylinositol (4,5)-bisfosfato
-
Rilascia di VR1 dal inibitori controllo: Bradykinin e Nervi crescita fattore
-
Funzioni
-
Nocicezione
-
Calore, Acid o Stretch indotte
-
Attivazione effetti
-
Releases neuropeptidi (sostanza P) dal nervo terminali
-
Causa bruciante dolore
-
Infiammazioni
-
Ipotermia
-
Integrates effetti di noxious calore, basso pH e vanilloid ligands on sensorio neuroni
-
Sperimentale modificazione
-
VR1 topi knockout
-
Gravemente deficiente in moderate calore-evocata risposta
-
Pochi calore-sensibile C assoni
-
Ridotta dolore comportamento ad alto temperature (> 50°C)
-
No aumentato sensibilità to calore dopo tessuto lesione
-
Anti-VR1 serico: Ameliorates thermal allodynia e iperalgesia in diabetico topo
-
TRPV2
 :
Vanilloid recettore-correlate (VRL-1)
:
Vanilloid recettore-correlate (VRL-1)
-
Localizzazione: Cervello; Midollo spinale; Milza; Polmone; Periferici sensorio neuroni
-
Fisiologia
-
Outwardly rectifying
-
Ions: Ca++ > Na+ permeabilità
-
Inibizione by ruthenium rosso
-
Noxious calore sensazione: Attivate a 53 °C
-
TRPV3
 : VRL-3
: VRL-3
-
Localizzazione: Keratinocytes
-
Attivazione
-
Temperature elevate (25 a 40 °C
-
Alte risposta a noxious caldo temperature
-
TRPV4

 :
VRL-2
:
VRL-2
-
Localizzazione: Cervello; fegato; Reni; Grassi; Il cuore; Testicoli; Salivary gland; Trachea
-
Outward rectifying
-
Attivazione
-
Ridotta osmolarity
-
Media sensibilità di nocicettive dorsale radice gangli neuroni to hypoosmotic sfida
-
Mechanosensitive: ? via 2a messenger
-
Temperature elevate (25°C–40°C)
-
TRPV5

 :
ECAC-1
:
ECAC-1
-
Localizzazione: Intestine; Reni; Placenta
-
Rettificazione retrograda
-
Ca++ selettivo
-
Conductance la dipendenza in assenza di divalent catiions
-
Associata con 1,25 dihydroxyvitamin D3-dipendenti calbindin-D28K
-
? Ruolo in Vitamina D rispondente Ca++ apporto
-
TRPV6

 :
ECAC-2
:
ECAC-2
-
Localizzazione: Largamente sparse
-
Ca++ selettivo
-
Rettificazione retrograda
-
Passes la maggior parte delle corrente a hyperpolarized potenziali
-
Attivate by Ins(1,4,5)P3 e thapsigargin-mediata store deplezione
-
TRPM (lunga TRP, Melastatin)
-
TRPM1


-
Occhi (Melanocytes)
-
Down-regolazione pronostici marcatore per metastasis
-
TRPM2

-
Cervello (Fetal e Adulto), Placenta
-
ADP-ribosio regolazione
-
Non-selettivo canale
-
TRPM3

-
TRPM4

 :
:
-
La livelli più alti: Il cuore; Prostate; Colon; Reni (In feto)
-
Attivate by Intracellulare Ca++
-
Conducts monovalent cations: Na+ e K+
-
Modulates potenziale di membrana
-
TRPM5

-
Forte outward rectification
-
Nonselettivo fra le monovalent cations
-
Non permeabile to divalent cations
-
Regolati by
-
Intracellulare Ca++: Activates e Desensitizes
-
PIP2: Reverses desensitization
-
Espressione selvatica
-
Gusto transduction canale
-
Associata con Beckwith-Wiedemann sindrome
-
TRPM6


-
Le mutazioni in ipomagnesemia con secondaria ipocalcemia (HSH)

-
TRPM7 (TRP-PLIK)

-
Reni, Il cuore, fegato, Milza, Polmone, Cervello
-
Regolati by attività del Carboxy terminale chinasi
-
Non-selettivo, intero cellule corrente
-
TRPM8

-
Voltaggio-dipendenti controllanti freddo-sensibile canale
-
Attivazione
-
iniziale attivazione: Raffreddando to 28 °C
-
Attività la dipendenza come temperature diminuisce: Aumentati probabilità del Canale apertura
-
Saturation: 10 °C
-
Menthol recettore on assoni
-
Nonselettivo outwardly rectifying canale
-
Prostate, specialmente neoplasms
-
sovraregolata by NGF
-
TRPN
-
Caratteristiche generali
-
Contiene ankyrin ripetizioni in N-terminali
-
Senza dolore

-
Stimulus: Heating (Noxious) to > 41°C
-
Presente nei multidendritic neuroni: CNS e PNS
-
no-mechanoreceptor-potenziale C (nompC)

-
Stimulus: meccanica (Capelli)
-
Ankyrin-simili proteina con dominio transmembranico 1 (ANKTM1)

-
Freddo-attivata canale: < 17 °C; Noxious
-
Localizzazione: nocicettive freddo-sensibile sensorio neuroni
-
CoEspressa con la capsaicin/calore recettore
-
Sensoria neuroni risponde to capsaicin ma non to menthol
-
Pyrexia
-
Gene codifica 2 proteine: PYX-PA e PYX-PB
-
Sequenza homologies to altre TRP proteine: ANKTM1; Senza dolore
-
Subunità forma eteromerici canali
-
Espressa lungo dendriti di un sottoinsieme di periferici sistema nervoso neuroni
-
Aperto by temperature sopra 40 °C
-
Più permeabile to K+ che to Na+
-
Protegge contro alto temperature sforzo
-
PKD (Polycystin) Famiglia
-
PKD Funzione
-
PKD1 e PKD 2 interagisca per produrre Ca++-permeabile nonselettivo catione correnti
-
Canali ionici: Contributes to liquidi-flow sensazione by primaria cilium in renale epitelium
-
Attivate by bending della apicale cilium in alcuni epitelio
-
Sensori liquidi flow parallel al epiteliari superficie.
-
PKD1
 :
Polycystic reni malattie, Dominante
:
Polycystic reni malattie, Dominante
-
PKD2
 :
Polycystic reni malattie, Dominante
:
Polycystic reni malattie, Dominante
-
Mucolipin 1 (MCOLN1)

-
Cationic canale
-
Funzioni
-
Endocytic percorso
-
Controllo della membrana movimentazione di proteine e lipidi
-
? Ca++ trasporto regulating lososomici esocitosi
-
Mucolipidosis IV

-
Mucolipin 2 (MCOLN2)

-
Mucolipin 3 (MCOLN3)

-
Topo malattie: varitint-waddler
(Va) con tricolor e perdita di udito
GAP
DI GIUNZIONE23
|
|
|
gap di giunzione
|
PROTEINE LEGANTI DEI CANALI IONICI: intracellulari
|
Canali ionici |
Binding proteina |
meccanismi e Effetto |
|
K+ canale, Controllolati dal voltaggio
Shaker tipo
NMDA recettore

NR2 subunità |
Chapsyns*: PSD-95
 ; ;
SAP97
 ;
Chapsyn-110 ;
Chapsyn-110
 ; ;
Sap102
 ;
Dlg ;
Dlg

|
Binding via PDZ** domini
1a e 2a on PSD-95
Post-sinaptico densities nel CNS
|
|
NMDA recettore

NR1 subunità
|
Actinina α

|
Actina Legante proteina
Concentrata in dendritic spines |
|
Recettore della glicina (GlyR)
|
Gephyrin

|
Legami alla β Intracellulare ansa
di GlyR e tubulin
|
|
AChR: Nicotinic
|
Rapsyn/43K
|
Giunzioni neuromuscolari localizzazione
|
|
Na+ canale
Controllolati dal voltaggio
|
Ankyrin G

|
Nodo di Ranvier localizzazione |
|
AMPA recettore
GluR2 subunità

|
Glutamato recettore
interActinag proteina (GRIP)
|
Binding via PDZ dominio
Couples recettore to citoscheletrica
e segnalazione molecole |
|
Glutamato recettore
Metabotropic
Subunità: mGluR1a

e mGluR5

|
Homer
|
Binding via PDZ-simili dominio
Espressione é by sinaptico attività
|
* Belong to Membrane Associata Guanylate Kinase (MAGUK) Famiglia
Chapsyn = Canale Associata proteina di synapse
** PDZ domini: omologhe 90 sequenze amino acide ripetizioni; Bind altre proteine
RECETTORI
DELL'ACETILCOLINAI: Malattie
-
Muscoli
-
Neuronali
-
Immune neuropatie: Isaac's;
subacuta autonomo
-
Epilessia
-
Notturno lobi frontali, Tipo 1

l Nervose nicotinic, α4
subunità

 ;
Cromosoma 20q13.2-q13.3; Dominante
;
Cromosoma 20q13.2-q13.3; Dominante
-
Notturno lobi frontali, Tipo 3

l Nervose nicotinic, β2
subunità (CHRNB2)
 ;
Cromosoma 1p21; Dominante
;
Cromosoma 1p21; Dominante
-
Schizophrenia: Attention malattie
-
Mancanza della inibizione di P50 risposta to uditive stimolo
-
Collegata to dinucleotide polimorfismo a 15q13-q14: Site di α-7-nicotinic
recettore

-
Topo knockouts
-
letale: e-Subunità AChR perdita
-
CNS neuronale perdita con subunità knockout
-
Nervose nicotinic, β2 subunità degli AChR (CHRNB2)

-
Difetti localizzata in CA1 e CA3 campi in ippocampo e neocorteccia
-
α7 subunità: Minimal fenotipo
-
α9 subunità: alterato innervazione di cochlOrecchie cellule cigliari
-
Disfunzione autonoma
-
Knockouts di nervose nicotinic Subunità AChR
-
α3
 :
Vescica ingrandimento; Dilatate, unresponsive pupille
:
Vescica ingrandimento; Dilatate, unresponsive pupille
-
β2

-
Nicotine-elicited anti-nociception: Ridotta
-
Neuroni in ippocampo e neocorteccia: Ridotta
-
α4

-
Nicotine-elicited anti-nociception: Ridotta
-
Muscarinic
-
Tossine
-
Nicotinic agomisti: Nicotine; Anatoxin A
-
Nicotinic antagomisti
-
Muscarinic agomisti: Muscarine; Arecoline; Pilocarpine; Verde mamba Serpente
-
Muscarinic antagomisti: Scopolamine; Atropina
RECETTORI DELLA GLICINA
RECETTORI
DEL GLUTAMATO
RECETTORI DELLA DOPAMINA
lunga QT Sindromes16
-
Cardiovascolare malattie con tachiaritmie: Prolungata ventricolare repolarization
-
fibrillazione ventricolare
-
Torsade de Puntiformees
-
Fibrillation con waxing e waning
-
Dovuta a cambiando axis di depolarizzazione
-
Generale: molecolare caratteristiche
-
Tutte LQT sindromi causata da K+ canale malattie eccetto LQT3
-
Meccanismi: Current erano portatori by difettose Canali potassio è insufficiente by ridotta controllanti o modificati canale cinetiche
-
Epidemiologia
-
Portatori: 1 in 10 000 persone
-
Congenita lunghezza QT sindrome causa 3000 a 4000 improvvisa morti in bambini e giovani adulti per anno in US
-
Insorgenza: 50% by 12 anni; 90% by 40 anni
-
Sindromi cliniche
-
Autosomica-dominante (Romano–Ward sindrome): Pure cardiaca fenotipo
-
Autosomica-recessiva (Jervell e Lange–Nielsen sindrome): Associazione
con congenita neuronale Sordità
-
Acquisita lunghezza QT sindrome: Dovuta a electrolyte disturbi o farmaco terapia
-
Fattori di rischio per sincope o improvvisa cardiaca morte
-
Congenita Sordità
-
Storia di sincope
-
Femmine: Cardiaco eventi più comune generalmente e durante gravidanza
-
Maschi: Rischio più alti nella fanciullezza
-
Documented torsade de Puntiformees o fibrillazione ventricolare
-
Età a primi episodio
-
Durata della corretta intervallo QT (QTc)
-
Caratteristiche cliniche
-
Sincope
-
Attacchi epilettici
-
Morte improvvisa
-
Trattamento: β-bloccanti Può reduce rischio del Cardiaca eventi, specialmente LQT1
-
Tipi

Concetti in channelopathies
 Quali sono the proprietà delle mutazioni nel chloride canale gene (CLC1)
che determine se una sindrome è ereditata in una dominante o recessiva Modello?
Quali sono the proprietà delle mutazioni nel chloride canale gene (CLC1)
che determine se una sindrome è ereditata in una dominante o recessiva Modello?
La dominante o recessiva nature di una mutazione dipendono sulla
Abilità della mutante chloride canale monomeri to polymerize con normale
canale monomeri. Dominante mutazioni complesso con normale monomeri
producente difettose canali. Per alcuni mutazioni uno anomali monomere è
sufficiente to destroy la funzione di una tetramero complesso (per es. Pro480Leu).
Per altre mutazioni (per es. Gly230Glu) it richiededue abnomal monomeri to
destroy il canale funzione di una tetramero. In sia caso, solo a
minoranza di tetrameri rimangono funzionale e miotonia Risultano.
mutazioni recessive do non complesso con normale monomeri. Normale
monomeri sono poi libero to complesso con altre normale monomeri. Questa
producente abbastanza funzionale tetrameri in eterozigote (50% della usuale
ammontare) per preservare normale membrane excitablity e miotonia does non
Avviene.

 Quali sono the proprietà delle mutazioni nel sodio canale gene (SCN4A)
che determine se una sindrome presenti con miotonia, paramiotonia, o debolezza?
Quali sono the proprietà delle mutazioni nel sodio canale gene (SCN4A)
che determine se una sindrome presenti con miotonia, paramiotonia, o debolezza?
Molte mutazioni produce anomali inattivazione della sodio canale.
Questa Risultano in aumentato sodio conduttanza e depolarizzazione della membrana.
Lieve depolarizzazione è Associata con aumentato membrane eccitabilità e
miotonia. Forte depolarizzazione producente membrane inexcitability e
debolezza. Alcune mutazioni solo reduce inattivazione a basso temperature
producente paramyotonic malattie (miotonia o debolezza peggio nel freddo).
Le mutazioni nel inattivazione gate (aminoacido 1306) produce differenti
gradi della gravità della malattia dipendenti sulla dimensione e charge della lato
catena della potenziale aminoacido. Alanine, con una brevi lato catena producente
lieve
miotonia fluttuante. Valine, con un intermedio lato catena, producente
paramiotonia congenita. l'acido glutamico, con una lunghezza lato catena ed una
negative charge, Risultano in
miotonia
permanente.

TOSSINE DEI CANALI
Ciguatera toxins7,8,11
-
Epidemiologia
-
geografica distribuzione
-
Caribbean
-
Indo-Pacific
-
Australia: Northeastern coast pesce; Outbreaks in Sydney
-
Incidenza
-
10,000 a 50,000 annually
-
più comunemente malattia 2° finfish consumo
-
si ha in sottili insiemi dei pazienti il quale shsonod uno, o a pochi, grossi pesce
-
Alcune Pacific e Caribbean isola nations fino a 10% incidenza
-
paziente caratteristico
-
Maschi > femmine
-
Età: 2a e 3a decade
-
Older individui
-
sintomatica primi poisoning più comune
-
Acuta sintomi più gravi
-
Durata dei sintomi più lunga
-
Food catena
-
Microalgae contaminated con Gamberdiscus: Benthic
dinoflagellate on dead coral
-
Herbiverous pesce consume contaminated microalgae
-
Carniverous pesce eat contaminated herbivorous pesce
-
tossine è concentrati in tutti tessuti del Carnivorous pesce: Specialmente fegato e altre viscera
-
umano ingestione di pesce con alto concentrazione di tossine causa ciguatera malattie
-
Tossici livelli: > 0.1 ppb (0.1 μg/kg)
-
Solitamente con ingestione di grossi pesce:
Raramente < 2 kg; Specialmente > 10 kg
-
Tossicità
-
Ingestione: Contaminated predatory pesce
-
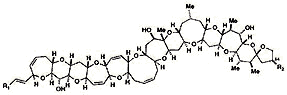
tossine
-
Tipo: Lipophilic ciclico polyether
-
Proprietà
-
Calore-stabili
-
Lipidi solubile: lunga retention in neuronale lipidi membrane
-
Dinoflagellate tossine (Gambierdiscus toxicus)
-
Associata con dead coral e blue-verde algae
-
> 20 differenti gambier- e Ciguatossinas
-
Ciguatossinas legano to site 5 (transmembranici segmento) on subunità α di Na+ canale
-
La maggior parte prolong Na+ canale apertura
-
Una blocchi Na+ canali
-
Prodotta in precursore forma by Gamberdiscus toxicus
-
Biotransformato to attiva tossine in pesce
-
Ciguatossina tipi
-
Pacific: Pacific-Ciguatossina-1 (P-CTX-1)
-
Caribbean: Caribbean-Ciguatossina-1 (C-CTX-1)
-
Meccanismi di azione
-
Inattivazione dei voltaggio-controllati Na+ canali
-
Aumenta nervo membrane eccitabilità
-
P-CTX-1
-
TTX-sensibile Na+ canali aprire closer a normale a potenziale di riposo di membrana
-
TTX-resistente Na+ canali recover dal inattivazione più rapidamente
-
Clinica
-
Insorgenza rapida: 4 a 16 ore dopo ingestione
-
GI: Vomito; Diarrea; Addominali dolore
-
Può produrre electrolyte disturbi o disidratazione: Specialmente bambini
-
Decorso: Auto limitanti over < 36 ore
-
Cardiaco
-
Vasomotor: Bradicardia; Ipotensione
-
Sofferenza: Mialgie; Crampi; Pruritis; Cefalea
-
Tempo più lungo sintomi: Insorgenza dopo 12 ore
-
più comunemente: Debolezza; Joint e Dolore muscolare; parestesie
-
Sensoria
-
Intorpidimento
-
Intense parestesia e Pruritis
-
Spesso presentazione sintomi
-
Specialmente in estremità
-
Centrifugal diffondersi dal bocca e lingua
-
Durata: Giorni to Mesi
-
"Reversal" di caldo e freddo sensazione
-
Freddo objects produce sconfortevoli bruciante
-
calda: Fluidi specialmente disturbing; Freddo-sharp sensazione
-
Feelings di loose teeth
-
Gusto disturbazione: Metallic
-
Dolore: Arti; Cute; Joints; Dental; Urethral
-
Muscoli
-
Dolore
-
Debolezza
-
Possono essere correlate to nervose coinvolgimento o infiammatori miopatia
-
Diffuse
-
disfagia
-
Fatica
-
Autonomo
-
Hypersalivation
-
Bradicardia
-
Laryngospasm
-
Ipotensione
-
Pupille: grossi o Sottili
-
CNS
-
Cefalea: Possono essere presentazione caratteristica
-
Depressione
-
Cerebellare: Spesso più tardi insorgenza (Fino ai 10 giorni); Atassia; Tremore
-
Breve tempo perdita di memoria
-
Insonnia
-
Coma in casi gravi
-
Morte
-
Frequenza
-
Mortalità è regioni-specifico: Fino ai 20% in occasionali episodi
-
Pacific < 1% dei pazienti
-
Dovuta a: Shock; Insufficienza respiratoria
-
si ha quando più tossici parti di pesce (fegato, roe) ingested
-
Recupero
-
Tempi di decorso: 6 to 24 mesi
-
La maggior parte persistente sintomi: Pruritis; Arthralgia; Fatica
-
? tossine conservato in adipose tessuto
-
Esacerbazioni con: Alcol ingestione; Stress; Esercizio; Perdita di peso
-
Cronica sindrome
-
Frequenza: 3% a 20% di gravi intoxications
-
Faticabilità
-
Debolezza
-
Depressione
-
Hypersomnolence
-
Subsequent attacchi
-
Spesso più gravi che 1a attacchi
-
Pazienti più sensibile to basso dosi di tossine
-
Evita il mangiare pesce per 6 mesi dopo iniziale attacchi
-
Gravidanza
-
? Aumentati Movimenti fetali
-
Neonati dopo esposizione: Normale o transitoria debolezza
-
? Breastfeeding Può transmit tossine
-
Trattamento
-
sintomatica: Analgesici; Antiistaminas
-
Mannitol: In 1a 48 ore; 1g/kg over 1/2 a 4 ore; Possono essere ripetuta 1 o 2 volte
-
Diagnosi differenziale
-
Clupeotoxism
-
Fonte: Sardines e Herring (Clupeoid pesce)
-
Probabile Associata organismo: Ostreopsis siamensis (Benthic dinoflagellate)
-
Attiva agente: Palytoxin
-
Converte Na+/K+ pompa nella nonselettivo catione canali
-
Causa depolarizzazione, Na+ accumulazioni e Ca++ sovraccarico
-
Clinica
-
Produce una sindrome simile to ciguatera: Possono essere lieve o fatale
-
Dolore: Muscoli e Back; CK alto; scure urine
-
Laboratorio
-
Elettrofisiologia
-
NVC lenta e F-onde
-
Prolungata refrattari periodi
-
Repetitive assonali firing
-
Lieve casi
-
Normale routine elettrofisiologia
-
Latente tetania: multiplette persisting > 2 min dopo cessation di iperventilazione o ischemia
-
Plasma colinesterasi: Ridotta in 80%
-
Esaminazione diagnostica
-
Topo bioassay: Injection di pesce estratti
-
Immunoassay per Pacific-Ciguatossina -1
-
Conferma by liquid cromatografia/spettrometria di massa tandem
-
Patologia: cellule di Schwann citoplasma edema
Conotoxins
Lidocaine
-
Blocca voltaggio-controllati Na+ canali
-
Usage dipendenti
-
Richiede aprire Na+ canali
-
Dosage effetti
-
Parziale blocco: NVC lenta
-
più alto dosaggio: Blocco di conduzione
-
Molto alto dose: K+ canale blocco quindi
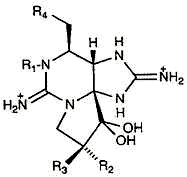
Saxitoxin
-
Tossicità
-
Ingestione: Contaminated shellfishfish
-
Dinoflagellate tossine (Gonyaulax)
-
Tipo di tossine: Guanidinium; Heterocyclic
-
meccanismi di azione
-
Legami alla site 1 on voltaggio controllati Na+ canale
-
Blocca Na+ flusso
-
Clinica
-
Insorgenza rapida
-
Intorpidimento: labbra, lingua, estremità
-
Debolezza: Estremità, bulbare, respiratorie
-
Riflessi tendinei: Preservate Early
-
CNS: Coma
-
Sistemico: Aritmie cardiache
-
Recupero: 4 a 5 giorni
-
Diagnosi differenziale:
Tetrodotossina e
Crab poisoning
produce simile sindromi cliniche
-
Laboratorio
-
Elettrofisiologia
-
NVC lenta
-
lunga distale latenza
-
Sottili motorio e sensorio potenziali di azione
-
Blocco di conduzione
-
Patologia: No morfologico alterazioni
Tetrodotossina
-
Tossicità
-
Ingestione: impropriamente preparato pesce
-
Fugu rubripes (puffer); Sheroides rubripes (globe)
-
Concentrata nel fegato, gonads e cute
-
Solita modelli di ingestione
-
Served dal Ottobre attraverso le March
-
Served con abbastanza tossine: Causa tingling delle labbra
-
tossine
-
Tipo: Guanidinium; Heterocyclic
-
Prodotta by batteri (Alteromas), non direttamente by pesce
-
meccanismi di azione
-
Legami alla site 1 on voltaggio controllati Na+ canale
-
Neutralizzazione di negative aminoacidi 942 e 945 di S5-S6 ansa riduce Legante
-
Puffer pesce hanno Na+ mutazione del canale: Ridotta tossine Legante to own canali
-
Blocca Na+ flusso
-
Guanidinium moiety entra canale
-
In azione indipendente di se canale è aprire o chiuso
-
Ridotta propagazione dei potenziali di azione
|
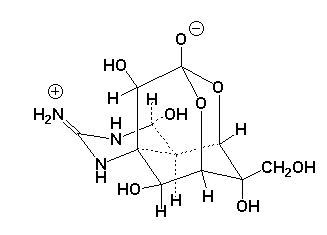
|
|
Tetrodotoxin |
-
Clinica
-
Insorgenza rapida: 15 minuti to 12 ore dopo tossine ingestione
-
Intorpidimento e parestesia
-
labbra, lingua, estremità
-
Debolezza
-
Estremità, bulbare, respiratorie
-
Riflessi tendinei: Preservate Early
-
CNS: Coma
-
Sistemico
-
Aritmie cardiache
-
Ipotensione
-
Recupero: 4 a 5 giorni
-
Laboratorio
-
Elettrofisiologia
-
NVC lenta
-
lunga distale latenza
-
Blocco di conduzione
-
Sottili motorio e sensorio potenziali di azione
-
Patologia: No morfologico alterazioni
-
Prognosi
-
Mortalità: Alte (50%)
-
Buone dopo sopravvivenza per 24 ore

Ritorno a Miopatie
Ritorno a Neuromuscolare
Sindromi
Riferimenti
1. TINS Integratore: giugno 1996
2. tossine illustrazioni dal Ion Canale Ricerca
3. Neurologia 1997;49:1196-1199
4. Curr Opin Neurobiol 1999;9:267-273
5. Trends in neuroscienze 1999;22:488-495
6. Am J Hum Genet 2000;66 (Maggio)
7. Medical Jourmal di Australia 2000;172:176-179
8. Medical Jourmal di Australia 2000;172:160-162
9. Physiol Rev 2000;79:1317-1372; Clin Neurophysiol 2001;112:2-18
10. TINS 2000;23:393-398, Arch Neurol 2003;60:496-500
11. Muscoli Nervi 2000;23:1598-1603; JNNP 2001;70:4-8
12. Nature rassegnas: Neuroscience 2001;2:387-396
13. Arch Neurol 2001;58:1649-1653
14. Physiol Rev 2002;82:503-568
15. Nature 2002;417;501-502
16. Ann Intern Med 2002;137:981-992
17. Nature Neuroscience 2003;6;468-475
18. Fisiologica rassegnas 2003;83:117-161
19. Ann Neurol 2003;54:239-243
20. Nature 2004;430:232-235
21. Hum Mol Genet 2004;13:1703–1714
22. Molec Neurobiol 2004;30:279-305
23. Molec Neurobiol 2004;30:341-357
14 febbraio 2005
Va a Acronimi e sigle
Va a Mitolario in
italiano
Va a Mitolario italiano -
inglese
Va a Mitolario inglese -
italiano
![]() Traduzione di Natale Marzari
Traduzione di Natale Marzari
![]() contenente tipo L canali ((+/-)Bay K 8644)
contenente tipo L canali ((+/-)Bay K 8644)
![]() 1
1
![]()
![]()

![]() :
Polmone, Cervello, Muscoli (Smooth), Il cuore, Occhi; Attivate by DAG; Inward e Outward rectifying
:
Polmone, Cervello, Muscoli (Smooth), Il cuore, Occhi; Attivate by DAG; Inward e Outward rectifying![]() 21
21
![]() :
Formazione di funzionale gap Giunzioni in neocorteccia interneurons
:
Formazione di funzionale gap Giunzioni in neocorteccia interneurons
![]()
![]() ;
Cromosoma 4q31.3; Sporadica o recessive
;
Cromosoma 4q31.3; Sporadica o recessive
![]() )
)
![]()
![]() Quali sono the proprietà delle mutazioni nel chloride canale gene (CLC1)
che determine se una sindrome è ereditata in una dominante o recessiva Modello?
Quali sono the proprietà delle mutazioni nel chloride canale gene (CLC1)
che determine se una sindrome è ereditata in una dominante o recessiva Modello? ![]()
![]() Quali sono the proprietà delle mutazioni nel sodio canale gene (SCN4A)
che determine se una sindrome presenti con miotonia, paramiotonia, o debolezza?
Quali sono the proprietà delle mutazioni nel sodio canale gene (SCN4A)
che determine se una sindrome presenti con miotonia, paramiotonia, o debolezza? ![]()

![]()