|
Fondazione FONAMA |
fonama@fonama.org |
Tel. 335250742 |
 |
 |
Traduzioni a cura di Natale Marzari
Dopo 41 anni e 5 mesi, nel maggio 2006 la
magistratura di Trento ha riconosciuto l'esistenza e la gravità di quella
malattia rara che nessuna altra istituzione o persona singola della provincia di
Trento ancora mi riconosce, e per negare la quale ancora mi perseguita.
Natale Marzari |
Componenti della catena respiratoria
Il sistema degli enzimi mitocondriali e molecole trasportatrici redox che traghettano riducendo gli equivalenti dai substrati
all'ossigeno sono conosciuti collettivamente come il sistema di trasporto degli
elettroni, o la catena respiratoria. Questo sistema cattura l'
energia libera disponibile dalla ossidazione del substrato così che essa possa essere più tardi impiegata per la sintesi dell'ATP. Molti componenti della catena respiratoria furono
inizialmente identificati in omogeneizzati crudi attraverso le loro proprietà spettrali, che cambiano frequentemente quando un trasportatore viene ossidato o ridotto. Il frazionamento dei mitocondri in presenza dei detergenti delicati o
di sali chaotropici ha frazionato la catena respiratoria in quattro
grandi complessi con molte sub-unità che contengono gli
elementi portanti respiratori principali, chiamati complesso I, II, II e complesso
IV.
Questa notevole proteina "iceberg" galleggia nel doppio foglio lipidico della membrana
interna, spesso presentando una faccia nella matrice mitocondriale
ed un altra nello spazio intermembranico. Molti dei loro componenti ora sono stati
isolati in una forma
relativamente pura. Altri enzimi legati alla membrana quale la transidrogenasi
collegata all'energia (ELTH) sono inoltre presenti e coprono ruoli secondari.
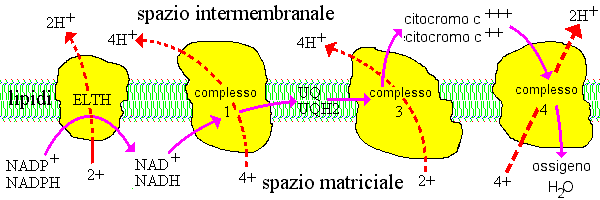
I componenti principali partecipano in ordine approssimativo ai loro
potenziali ossidoriduttivi, ed i complessi ingombranti sono collegati dagli
elementi portanti
mobili del peso a basso peso molecolare che trasportano gli equivalenti di
riduzione da un complesso al seguente. Tranne la succinato deidrogenasi del
(complesso 2) tutti questi complessi pompano
protoni dallo spazio della matrice nel
citosol mentre trasferiscono gli equivalenti di riduzione (atomi o
elettroni dell'idrogeno) da un elemento portante al seguente. Lo schema qui
sopra mostra il flusso di riduzione degli equivalenti in colore porpora, e movimento dei protoni positivamente carichi
in colore rosso.
Il pompaggio dei protoni è un'operazione ardua che genera il pH
notevole e un gradiente di potenziale elettrico attraverso la membrana interna
mitocondriale. Quei protoni che eventualmente rientrano nella matrice via atpasi F1, azionano la sintesi dell'ATP
al loro rientro.
Il numero di protoni ed il numero di cariche positive che attraversano
la membrana interna non devono necessariamente servire per
ogni specifica proteina transmembranico, anche se l'utilizzo deve equilibrare
per l'intero insieme. Questa discrepanza è illustrata sullo schema qui sopra, ed
è spiegata più dettagliatamente qui sotto.
La sequenza degli elementi portanti nella catena respiratoria è stata
chiarita tramite l'uso degli specifici inibitori
per bloccare il flusso
degli elettroni dai substrati ad ossigeno. Tutti i componenti dal lato del
substrato di un blocco sono ridotti, mentre quelli che seguono sono ossidati.
Questi cambiamenti possono essere osservati spesso spettroscopicamente. Se
è disponibile una gamma di inibitori,
attivandoli in posti differenti, si definisce allora il loro preciso punto di azione e l'ordine degli
elementi
portanti.
Ulteriori informazioni sono state spigolate dall'uso dei mediatori redox artificiali. Donatori di elettroni, quale l'ascorbato [ vitamina C ] più
la diammina tetrametilica
compound sintetico del fenilene può fornire elettroni al
citocromo c, mentre ricettori artificiali quale ferricianuro raccoglierebbero
gli
elettroni dal complesso I o dal complesso 2 ed escluderebbero il resto
della catena. Ciò ha potuto essere particolarmente informativo quando usato
insieme con gli inibitori specifici, o quando i rendimenti dell'ATP sono stati misurati
per un particolare segmento della catena.
Componenti della catena respiratoria
[ clicca per i particolari supplementari ] |
Posizione |
Gruppi prostetici |
Funzione |
| NADPH
/ NADP (quasi 100% nella forma ridotta) |
spazio della matrice (ambiente citosolico separato) |
- |
portatore mobile |
transidrogenasi
legata all'energia NADPH + NAD+
=> NADH + NADP+ |
Proteina membrano-tensiva |
nessuno |
pompa protonica 2H+/2e-1 |
| NADH
/ NAD (più meno di 30% nella forma ridotta) |
spazio della matrice (ambiente citosolico separato) |
- |
portatore mobile |
NADH
deidrogenasi
(complesso I) |
Proteina
membrano-tensiva con molte sottounità |
Ferro non-eme
& FMN |
pompa protonica 4H+/2e-1 |
succinato
deidrogenasi
(complesso II) [vedi nota 1] |
Proteina
membrano-tensiva con molte sottounità |
Ferro non-eme
& FAD |
pompa non protonica
|
| ubichinolo
/ ubichinone |
dissolto all'interno dei lipidi della membrana |
- |
portatore mobile |
| ubichinolo: citocromo
c riduttasi (complesso III) |
Proteina
membrano-tensiva con molte sottounità |
Ferro non-eme, eme b e eme c1 |
pompa protonica 4H+/2e-1
[vedi nota 2] |
citocromo
c
(ferroso/ ferrico) |
spazio inter-membranale |
Eme c |
portatore mobile |
| citocromo
c ossidasi (complesso IV) |
Proteina
membrano-tensiva con molte sottounità |
rame, eme a
e eme a3 |
pompa protonica 2H+/2e-1
[vedi nota 2] |
F0 / F1 ATPasi
(ATP sintetasi) |
Proteina
membrano-tensiva con molte sottounità |
nessuno |
pompa protonica
3H+ / ATP |
Nota 1: Oltre alla succinato deidrogenasi, parecchi altri enzimi
forniscono elettroni direttamente all'ubichinone. LAcil
CoA deidrogenasi è una flavoproteina solubile coinvolta nell'ossidazione degli acidi
grassi nello spazio della matrice mitocondriale.
Essa alimenta i relativi equivalenti di riduzione ad ubichinone per mezzo di una
flavoproteina a basso peso molecolare di trasferimento degli elettroni (ETF).
La glicerolo fosfato "ossidasi" è un'altra flavoproteina che
inoltre alimenta l'ubichinone di riduttori equivalenti. È una proteina della membrana
interna, ma le superfici altamente attive relative del centro reagiscono esternamente
con il
relativo substrato nello scompartimento citosolico, non nello spazio della
matrice mitocondriale. Nessuno di questi enzimi contribuisce a pompare protoni e che pompa, così
il rapporto
P:O dei loro substrati è solo 1,5
Nota 2: La stechiometria di pompaggio dei protoni per il complesso
III ed il
complesso IV è difficile perché il ricettore dell'elettrone per il
complesso III (citocromo c) è situato sulla parte esterna della
membrana interna, considerando che l'ossidante per il complesso IV (ossigeno
molecolare)
è ridotto sulla faccia interna della membrana interna. Se è necessario contare
le cariche negative degli elettroni che percorrono la catena cosi come le
cariche positive dei protoni. Inoltre, la
riduzione di ossigeno consuma due protoni "chimici" supplementari per
formare acqua, oltre a quelli che ha pompato nel complesso IV. Questi protoni
"chimici" non contano perché equilibrano esattamente i
due protoni "chimici" prodotti precedentemente quando gli atomi
dell'idrogeno sono stati rimossi durante l'ossidazione
del substrato. L'effetto netto di tutto questo è che il complesso III esporta
quattro protoni ma soltanto due cariche positive per ogni accoppiamento degli
elettroni che attraversano la catena respiratoria, mentre il complesso IV esporta
due protoni ma quattro cariche positive.
I liposomi sono vescicole membranose che si formano spontaneamente quando
molti fosfolipidi sono dispersi in mezzi acquosi. Se i lipidi vengono
semplicemente agitati in acqua si producono grandi
strutture multi-strato con "una disposizione a cipolla". Se i liposomi multi-strato sono trattati con
vibrazioni
ultrasoniche si rendono le vescicole unilamellari molto più piccole con
una membrana di limitazione semplice composta da un singolo doppio-strato
fosfolipidico. Sia i liposomi a strato singolo sia quelli multi-strato possono essere preparati
per essere impermeabili alla maggior parte degli ioni caricati, anche se
molecole non cariche, e
molecole idrofobe possono acceder all'interno. Al momento della formazione
dei liposomi rimane loro intrappolato dentro un piccolo volume del
mezzo originale della preparazione.
Ricostituzione: Se nella membrana sono
incluse proteine idrofobe durante il
trattamento con ultrasuoni del lipidi, questi sono incorporati nelle membrane del liposoma.
Questo metodo è stato usato per ricostituire la catena respiratoria da
frammenti purificati. Purtroppo le proteine adottano un orientamento casuale
mentre sono
incorporate nella membrana del liposoma, così metà di loro finiscono per
trovarsi inserite al contrario. È quindi difficile ricreare un gradiente protonico.
Sono state usate molte ingegnose tecniche per selezionare una
popolazione proteica correttamente orientata, per esempio intrappolando il
donatore di elettroni all'interno del
liposoma e fornendo l'accettore solo alla superfice esterna.
I liposomi vengono inoltre attivamente studiati come mezzo di
trasporto dei farmaci citotossici contro le cellule tumorali, le quali sono state
prima marcate con anticorpi monoclonali.


