|
Fondazione FONAMA |
fonama@fonama.org |
Tel. 335250742 |
 |
 |
Traduzioni a cura di Natale Marzari
Dopo 41 anni e 5 mesi, nel maggio 2006 la
magistratura di Trento ha riconosciuto l'esistenza e la gravità di quella
malattia rara che nessuna altra istituzione o persona singola della provincia di
Trento ancora mi riconosce, e per negare la quale ancora mi perseguita.
Natale Marzari |
Bioenergetica
Potenziali ossidoriduttivi: Questi forniscono
una misura quantitativa dell'ossidazione o del potere di riduzione. Gli agenti
con forte potere di ossidazione (come l'ossigeno molecolare) hanno potenziali
ossidoriduttivi positivi, i buoni agenti riduttori
hanno potenziali ossidoriduttivi negativi.
Gli elettroni si muovono spontaneamente verso quelle sostanze con i potenziali
ossidoriduttivi più positivi. Il campione per l'intera scala
è l'idrogeno puro gassoso ad 1 atmosfera di pressione in contatto con un
elettrodo di platino platinato
immerso in acido 1 molare. Questa combinazione è chiamata
elettrodo standard ad idrogeno (SHE)
ed è definita avere potenziale ossidoriduttivo zero.
I potenziali ossidoriduttivi standard (Eo) sono misurati con
il 50% di forma ossidata ed il
50% di forma ridotta per la sostanza in questione. [Questo è simile al pKa
nella equazione di Henderson Hasselbach,
la quale è eguale al valore del pH misurato con il 50% di amplificatore protonato ed
il
50% di amplificatore deprotonato.] Se la reazione di ossidazione / riduzione coinvolge
protoni (molte lo fanno) allora si deve essere in presenza anche di acido 1 molare.
Questo è un po' inopportuno per i sistemi biologici, così spesso noi lavoriamo
con Eo' il quale
è il potenziale ossidoriduttivo misurato a pH 7. Questo ha un effetto
principale: a pH
7 l'idrogeno gassoso ha un potenziale ossidoriduttivo di -420 mV.
Il potenziale ossidoriduttivo efficace dipende dalla proporzione delle
forme ossidate e ridotte. Questo può costituire una grande differenza: la coppia NADPH / NADP
(mantenuta nelle cellule pressoché al 100% nella forma ridotta) è un agente
riduttore biologico molto migliore del NADH / NAD (non più del 30% ridotto in
normali condizioni) nonostante il fatto che i loro potenziali riducenti standard siano identici.
E = Eo + R T ln( [della forma ossidata] / [della forma ridotta]
) / z F
(E è misurato in volt, R è la costante del gas [8,31 joule / gradi
/ mole], T è la temperatura assoluta, F è la costante di faraday [96.500 coulomb / mole], z è il numero di elettroni coinvolti nella reazione
e ln denota il logaritmo naturale. Se il logaritmo naturale viene sostituito
dai logaritmi su base 10, questo deve essere moltiplicato per un fattore
di conversione di 2,303)
Notare che è insignificante parlare del potenziale
ossidoriduttivo per una singola sostanza isolata: devono essere definite entrambe
le forme ossidata e ridotta, sebbene in alcuni casi siano ovvii (per es. il NADH)
la cui forma ossidata è il (NAD). Per l'idrogeno gassoso la forma ossidata può essere sia protoni o
acqua (dovete specificare quale) mentre per l'ossigeno la forma ridotta è solitamente
sia ioni idrossile o acqua, ma potrebbe essere superossido o perossido,
e questo influenzerebbe il valore del potenziale ossidoriduttivo.
Il valore numerico di 2,303 R T/ La F è circa 60mV a 37oC.
Potete usare questa informazione per calcolare il cambiamento nel
potenziale ossidoriduttivo per l'idrogeno gassoso, andando dall'acido 1
molare in un elettrodo all'idrogeno standard al
campione biologico standard al pH 7,0?
Alcuni potenziali ossidoriduttivi possono essere misurati
direttamente (inserendo un elettrodo di platino in una miscela di forme ossidate
e ridotte, e completando il circuito tramite un ponticello del sale collegato ad
un elettrodo di riferimento adatto) ma i potenziali ossidoriduttivi biologici
sono ottenuti più comunemente indirettamente studiando la posizione di
equilibrio delle reazioni dove un partecipante ha un potenziale ossidoriduttivo
conosciuto. Se tutto è presenti in quantitativo equimolare, una buona coppia
riducente può ridurre una coppia più debole. Tuttavia, un agente riduttore
debole potrebbe ridurre un agente riduttore più forte, facendo si che la coppia più debole
si trovi ampiamente nella forma ridotta, e la coppia più forte ampiamente nella forma ossidata. Simili considerazioni
si applicano agli agenti ossidanti, con gli argomenti appropriatamente invertiti.
Quando un reagente ossidante interagisce con un agente
riducente, la differenza
fra i loro rispettivi potenziali ossidoriduttivi  E
è correlata alla energia libera di Gibbs
E
è correlata alla energia libera di Gibbs
 G
per la reazione generale:
G
per la reazione generale:
 G = -
z F
G = -
z F  E
E
(dove  G è misurato in joule,
G è misurato in joule,
 E è misurato in volt, F è la
costante di faraday [96.500 coulomb / mole] e z è il numero di elettroni
trasferiti nella reazione). E' necessaria un po' di cura con i segni aritmetici
nel decidere quale numero dovrebbe essere sottratto da che cosa. Ricordare
che
E è misurato in volt, F è la
costante di faraday [96.500 coulomb / mole] e z è il numero di elettroni
trasferiti nella reazione). E' necessaria un po' di cura con i segni aritmetici
nel decidere quale numero dovrebbe essere sottratto da che cosa. Ricordare
che  G
è negativo se la reazione generale è favorevole.
G
è negativo se la reazione generale è favorevole.
I numerosi portatori di
elettroni che compongono la catena respiratoria sono organizzati in ordine
approssimativo ai loro potenziali ossidoriduttivi: le coppie di riduzione
migliori all'estremità del substrato e le coppie d'ossidazione migliori
all'estremità dell'ossigeno. Ai punti chiave lungo la catena, la differenza nel
potenziale ossidoriduttivo fra gli elementi portatori
adiacenti fornisce la forza di azionamento per pompare i protoni fuori dello
spazio della matrice nel citosol
come parte del meccanismo generale di accoppiamento energetico.
I potenziali ossidoriduttivi per alcune reazioni biologiche importanti
sono elencati nella tabella:
|
Reazione chimica
|
Eo' (mV) |
| isocitrato => ossoglutarato + CO2
+ 2e-1 |
-380 |
| idrossilbutirato => acetoacetato + 2e-1 |
-346 |
| piruvato + CoASH => acil-CoA + CO2 + 2e-1 |
? |
| NADH => NAD+ + H+ + 2e-1 |
-320 |
| lattato => piruvato + 2e-1 |
-190 |
| malato => ossaloacetato + 2e-1 |
-166 |
| succinato => fumarato + 2e-1 |
+30 |
| ubichinolo => ubichinone + 2H+ + 2e-1 |
+45 |
| citocromo c2+ => citocromo c3+ + e-1 |
+230 |
| H2O => 1/2 O2 + 2H+ + 2e-1 |
+820 |
Equazione di Nernst: Questa equazione ha
varie forme: non siate sorpresi se trovate un'altra versione. La forma
incontrata il più comunemente nei sistemi biologici collega
il potenziale della membrana alle concentrazioni di uno ione diffusibile in equilibrio con
il potenziale da ogni lato della membrana:
 = 2,303 R T log( [Cin] / [Cout] ) / z F
= 2,303 R T log( [Cin] / [Cout] ) / z F
(dove  è
il potenziale di membrana in volt, R è la costante del gas [8,31 joule / gradi / mole],
T è la temperatura assoluta, Cin e Cout sono le due concentrazioni ioniche,
z è la carica elettrica sullo ione, F è la costante di faraday [96.500
coulomb / mole]. Il fattore di 2,303 deriva dall'uso del logaritmo 10 invece
dei logaritmi naturali.)
è
il potenziale di membrana in volt, R è la costante del gas [8,31 joule / gradi / mole],
T è la temperatura assoluta, Cin e Cout sono le due concentrazioni ioniche,
z è la carica elettrica sullo ione, F è la costante di faraday [96.500
coulomb / mole]. Il fattore di 2,303 deriva dall'uso del logaritmo 10 invece
dei logaritmi naturali.)
Quando il sistema raggiunge l'equilibrio, la tendenza
degli ione
a diffondersi attraverso la membrana, seguendo il gradiente di concentrazione, è
bilanciato
esattamente dalla forza elettrica di attrazione nella direzione opposta. Il
potenziale di membrana cambia il segno se si inverte l'orientamento del
gradiente, o se si sostituisce la diffusione anionica con una diffusione
cationica mantenendo tutte le concentrazioni inalterate. Usate il vostro
buonsenso per distinguere: all'equilibrio, la concentrazione più alta di
ioni positivi sarà dal lato negativo della membrana, e viceversa.
A 37oC il valore di 2,303 R T / z F è circa 60mV
così il potenziale di membrana aumenta di 60mV per ogni aumento di 10 volte
del gradiente ionico.
E' la stessa cosa della misura elettrica con l'elettrodo a vetro per il pH (60mV
per unità di pH) il che non deve sorprenderci poiché il voltaggio aumenta per lo stesso meccanismo.
Notare che gli ioni devono poter attraversare la membrana
con movimento
della carica affinché la suddetta equazione sia valida, e deve essere raggiunto
l'equilibrio con il gradiente elettrico. L'equazione di Nernst non si applica
agli ioni non-permeanti, o a quelli che attraversano per un meccanismo di scambio
elettricamente neutro. Nessun lavoro utile può essere ottenuto da un gradiente ionico
coerente alla equazione di Nernst (vedere sotto per una discussione dettagliata) ma è possibile ottenere energia da un gradiente ionico
il quale
NON ha raggiunto l'equilibrio, per esempio il gradiente del sodio attraverso il plasmalemma, o il
gradiente dei protoni attraverso la membrana mitocondriale interna.
L'equazione di Nernst può essere usata per calcolare il potenziale
della membrana mitocondriale misurando la distribuzione di un catione
solubile nei lipidi come il tetrafenilammonio, o il rubidio più la
valinomicina.
Energia libera di Gibbs: ( G)
Questo è il lavoro utile che può essere ottenuto da una reazione chimica,
e riflette il suo spostamento relativo dall'equilibrio. Nessun lavoro utile può essere ottenuto da una reazione che ha
raggiunto l'equilibrio, ed in questo caso
G)
Questo è il lavoro utile che può essere ottenuto da una reazione chimica,
e riflette il suo spostamento relativo dall'equilibrio. Nessun lavoro utile può essere ottenuto da una reazione che ha
raggiunto l'equilibrio, ed in questo caso
 G
= 0.
G
= 0.
Per una reazione chimica dove una serie di reagenti Rn
forma una serie di prodotti Pm:
R1 + R2 + R3 + ... <=>
P1 + P2 + P3 + ...
il rapporto preciso fra
 G
ed il limite della reazione è dato
dall'equazione di Gibbs:
G
ed il limite della reazione è dato
dall'equazione di Gibbs:
 G =
G =
 G0
+ R T ln ( [P1] . [P2] . [P3] ... / [R1]
. [R2] . [R3] ...)
G0
+ R T ln ( [P1] . [P2] . [P3] ... / [R1]
. [R2] . [R3] ...)
(dove R è la costante del gas [8,31 joule / gradi / mole], T è la temperatura assoluta, e ln( )
è il logaritmo naturale di tutte le
concentrazioni del prodotto moltiplicate insieme, divise poi da tutte le
concentrazioni dei reagenti moltiplicate insieme). Se preferite lavorare con i
logaritmi su base 10, dovete moltiplicare l'intero ultimo termine qui
sopra [cominciando da R T ln( ....) ] per 2,303
 G0 è lo standard
per l'energia libera per la reazione, misurato quando tutti i reagenti ed i
prodotti sono presenti ad una concentrazione 1 molare.
G0 è lo standard
per l'energia libera per la reazione, misurato quando tutti i reagenti ed i
prodotti sono presenti ad una concentrazione 1 molare.
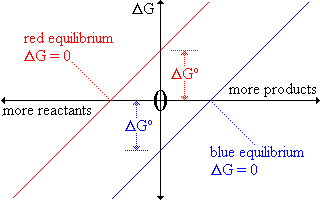 |
Questo grafico mostra il rapporto fra
 G
ed il progresso della reazione
per due reazioni chimiche differenti. G
ed il progresso della reazione
per due reazioni chimiche differenti.
reazione rossa:
 G0
è positivo G0
è positivo
reazione blu:
 G0
è negativo. G0
è negativo.
In entrambi i casi
 G è zero all'equilibrio,
ma la posizione di equilibrio di colore rosso favorisce i reagenti
mentre l'equilibrio del blu favorisce i prodotti. G è zero all'equilibrio,
ma la posizione di equilibrio di colore rosso favorisce i reagenti
mentre l'equilibrio del blu favorisce i prodotti.
|
L'asse orizzontale di questo grafico è R T ln ( [P1] . [P2]
. [P3] ... / [R1] . [R2] . [R3]
...)
Poiché  G è zero all'equilibrio,
ne segue che:
G è zero all'equilibrio,
ne segue che:
 G0 = - R
T ln ( [P1E] . [P2E] . [P3E] ... / [R1E]
. [R2E] . [R3E] ...)
G0 = - R
T ln ( [P1E] . [P2E] . [P3E] ... / [R1E]
. [R2E] . [R3E] ...)
dove l' E in pedice denota la concentrazione del reattivo o
del prodotto presente all'equilibrio. Sotto queste condizioni, i termini
all'interno delle parentesi tonde che rappresentano le
costanti di equilibrio, Keq per la reazione generale, portando alla importante conclusione che:
 G0 = -
R T ln (Keq)
G0 = -
R T ln (Keq)
dove Keq = [P1E] . [P2E] . [P3E] ...
/ [R1E] . [R2E] . [R3E] ...
Energia libera di un gradiente ionico: Nessun
lavoro utile non può essere ottenuto dagli ioni conformi all'equazione di Nernst
(a meno che non alteriate il gradiente elettrico) poiché questi ioni hanno
già raggiunto l'equilibrio con il potenziale di membrana, ma può essere ottenuta energia
dalla dissipazione di un gradiente per gli ioni non-diffusibili attraverso la stesso membrana.
Ci sono due componenti separabili in questa energia libera, una di queste deriva
dal gradiente elettrico attraverso la membrana, e l'altra dalla differenza nelle
concentrazioni ioniche. Per calcolare l'energia libera, immaginiamo che gli ioni
effettuino una certa operazione utile quando fuoriescono attraverso una membrana
molto piccola che separa due serbatoi enormi di capienza efficacemente infinita. Visualizzabile
spostando una mole di
ioni non-permeanti da un lato della membrana verso l'altro, mantenendo tutto
il resto costante (concentrazioni ioniche, tensioni)
 G = z F
G = z F
 + 2,303 R T log ( [Cout]
/ [Cin] )
+ 2,303 R T log ( [Cout]
/ [Cin] )
(dove
 G è
l'energia libera, z è è la carica sullo ione, F è la costante di faraday
[96.500 coulomb / mole] e
G è
l'energia libera, z è è la carica sullo ione, F è la costante di faraday
[96.500 coulomb / mole] e 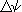 è
il potenziale di membrana, R è la costante del gas [8,31 joule / gradi / mole],
T è la temperatura assoluta, Cin e Cout sono le concentrazioni nei due
compartimenti). Il primo termine dal lato destro è come una fattura di
elettricità, essenzialmente amper x volt x tempo. Il secondo termine è una
forma un po' modificata della equazione di Gibbs, dove
gli ioni intrappolati sono visti come reagenti, e gli ioni fuoriusciti sono
visti come prodotti.
è
il potenziale di membrana, R è la costante del gas [8,31 joule / gradi / mole],
T è la temperatura assoluta, Cin e Cout sono le concentrazioni nei due
compartimenti). Il primo termine dal lato destro è come una fattura di
elettricità, essenzialmente amper x volt x tempo. Il secondo termine è una
forma un po' modificata della equazione di Gibbs, dove
gli ioni intrappolati sono visti come reagenti, e gli ioni fuoriusciti sono
visti come prodotti.
 G0
è zero perché non c'è nessuna energia
disponibile dal valore della
concentrazione se gli ioni hanno la stessa concentrazione da entrambi i
lati della membrana. Il fattore
di 2,303 consente di usare i logaritmi in base 10 al posto dei logaritmi naturali.
G0
è zero perché non c'è nessuna energia
disponibile dal valore della
concentrazione se gli ioni hanno la stessa concentrazione da entrambi i
lati della membrana. Il fattore
di 2,303 consente di usare i logaritmi in base 10 al posto dei logaritmi naturali.
La suddetta equazione permette pressoché infinite
opportunità di rielaborazione. Ricordarsi che
 G
è negativo per le reazioni favorevoli. Avete bisogno del segno corretto per il
potenziale della membrana, e la carica corretta sullo ione, e ricordarsi che il
secondo termine di concentrazione può aggiungere a o sottrarre dal primo termine
elettrico, a seconda che Cout sia più
grande o minore di Cin. Usate il vostro buonsenso per osservare che cosa sta accadendo, e poi inserite
correttamente i segni appropriati.
G
è negativo per le reazioni favorevoli. Avete bisogno del segno corretto per il
potenziale della membrana, e la carica corretta sullo ione, e ricordarsi che il
secondo termine di concentrazione può aggiungere a o sottrarre dal primo termine
elettrico, a seconda che Cout sia più
grande o minore di Cin. Usate il vostro buonsenso per osservare che cosa sta accadendo, e poi inserite
correttamente i segni appropriati.
Equazione di Henderson Hasselbach: Questa collega
il pH di una soluzione tampone alla ionizzazione costante per il tampone, e le proporzioni
delle forme protonate e non-protonate:
pH = pKa + log10 ([forma deprotonata] / [forma protonata])
E' facile ricordare che: più grande è la proporzione della
forma protonata, più acido deve essere il tampone. Per un sistema tampone
debolmente acido come l'acido acetico e l'acetato di sodio, l'acido acetico libero è
la forma protonata ed il sale è la forma deprotonata. Per una soluzione tampone
dell'ammonio, il sale sarebbe la forma protonata.
Il pKa riflette l'affinità intrinseca del
tampone per
i protoni, ed è semplicemente il logaritmo10 della costante di associazione, Ka:
| BH <=>
B- + H+ |
Ka
= [BH] / ( [B-] .
[H+] ) |
Di nuovo, è facile trovare il modo giusto: le
basi forti hanno grandi valori di pK, un pH alcalino e un'affinità forte per i
protoni. Quando un tampone è neutralizzato esattamente a metà, le concentrazioni delle
forme protonata
e deprotonata sono eguali. A questo punto il sistema ha la massima capacità di
tamponamento ed il pH = pKa


